Pilas
 El fundamento de las pilas y acumuladores es la transformación de la energía química en eléctrica, mediante reacciones de oxidación-reducción producidas en los electrodos, que generan una corriente de electrones
El fundamento de las pilas y acumuladores es la transformación de la energía química en eléctrica, mediante reacciones de oxidación-reducción producidas en los electrodos, que generan una corriente de electronesCuando se unen mediante un hilo metálico dos cuerpos entre los cuales existe una diferencia de potencial, se produce un paso de corriente que provoca la disminución gradual de dicha diferencia. Al final, cuando el potencial se iguala, el paso de corriente eléctrica cesa. Para que la corriente siga circulando debe mantenerse constante la diferencia de potencial.
En 1800, Alejandro Volta inventó un aparato generador de corriente. La pila de Volta (que él llamó «aparato electromotor de columna»> estaba constituida por un conjunto de pares de discos, unos de cobre y otros de cinc, con un disco de tela impregnada en agua salada —o en cualquier otro líquido conductor— intercalado entre dos pares sucesivos. Se trataba de un dispositivo muy cómodo y manejable, que funcionaba de modo continuo, y que posibilitó la aparición de nuevos descubrimientos sobre electricidad.
Funcionamiento de una pila electroquímica
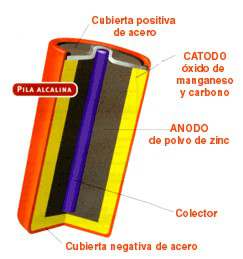 El funcionamiento de una pila es sencillo, consiste básicamente en introducir electrones en uno de los extremos de un alambre y extraerlos por el otro. La circulación de los electrones a lo largo del alambre constituye la corriente eléctrica. Para que se produzca, hay que conectar cada extremo del alambre a una placa o varilla metálica sumergida en un electrolito que suele ser una solución química de algún compuesto iónico. Cuando ese compuesto se disuelve, las moléculas se dividen en iones positivos y negativos, que se mantienen separados entre sí por efecto de las moléculas del líquido. El electrolito que utilizó Volta era ácido sulfúrico; cada una de sus moléculas, al disolverse en agua, se descompone en dos protones H+ (iones positivos) y un ion sulfato SO4- (ion negativo). Las varillas metálicas de cobre y cinc constituyen los electrodos, que deben ser sumergidos en el electrolito sin que lleguen a entrar en contacto. La placa de cobre es el electrodo positivo o ánodo y la placa de cinc el electrodo negativo o cátodo.
El funcionamiento de una pila es sencillo, consiste básicamente en introducir electrones en uno de los extremos de un alambre y extraerlos por el otro. La circulación de los electrones a lo largo del alambre constituye la corriente eléctrica. Para que se produzca, hay que conectar cada extremo del alambre a una placa o varilla metálica sumergida en un electrolito que suele ser una solución química de algún compuesto iónico. Cuando ese compuesto se disuelve, las moléculas se dividen en iones positivos y negativos, que se mantienen separados entre sí por efecto de las moléculas del líquido. El electrolito que utilizó Volta era ácido sulfúrico; cada una de sus moléculas, al disolverse en agua, se descompone en dos protones H+ (iones positivos) y un ion sulfato SO4- (ion negativo). Las varillas metálicas de cobre y cinc constituyen los electrodos, que deben ser sumergidos en el electrolito sin que lleguen a entrar en contacto. La placa de cobre es el electrodo positivo o ánodo y la placa de cinc el electrodo negativo o cátodo.Al reaccionar el electrolito con las varillas se produce una transmisión de electrones, que han sido extraídos de la placa de cinc, hacia la placa de cobre, con lo que los átomos de cinc son oxidados e incorporados a la disolución, según la reacción:
Zn —> Zn2++ 2e-
Esto ocurre así y no al revés, del cobre al zinc, porque los átomos de zinc tienen más tendencia que los de cobre a ceder electrones.
En la varilla de cobre se produce una reducción de los iones hidrógeno H+ de la disolución, ya que los electrones liberados por los átomos de zinc recorren el hilo conductor hacia la placa de cobre y son captados por los H+, que se convierten en átomos de hidrógeno y escapan en forma de gas. Estos electrones en movimiento son los que originan la corriente eléctrica.
Por su parte, los iones SO4- reaccionan con los cationes Zn2+ y se convierten en moléculas de sulfato de zinc.
2 H~+2e ---> H2
Zn2+ + SO42- ---> ZnSO4
Cuando se corta la conexión exterior entre las placas, los electrones no pueden desplazarse a lo largo del hilo de una placa a ¡a otra, con lo que se interrumpe la reacción.
El dispositivo funciona mientras existan átomos de zinc para formar el sulfato correspondiente. Cuando la placa de zinc se ha desintegrado por completo ya no puede producirse la reacción, por lo que la pila ya no tiene uso. Por este motivo, las pilas de este tipo reciben el nombre de pilas primarias.
De forma que, en resumen, los electrones tienen carga negativa, y como dos imanes a los que queremos acercar parte negativa con parte negativa o parte positiva con positiva, se repelen.
Esto significa que un electrón repelerá a otro electrón, debido a que éstos tienen carga negativa.
Pero, una carga positiva atraerá una carga negativa, como el electrón.
Las baterías, por medio de una reacción química producen, en su terminal negativo, una gran cantidad de electrones (que tienen carga negativa) y en su terminal positivo se produce una gran ausencia de electrones (lo que causa que este terminal sea de carga positiva).
Ahora, si esta batería alimenta un circuito cualquiera, hará que por éste circule una corriente de electrones que saldrán del terminal negativo de la batería, (debido a que éstos se repelen entre si y repelen también a los electrones libres que hay en el conductor de cobre), y se dirijan al terminal positivo donde hay un carencia de electrones, pasando a través del circuito al que está conectado. De esta manera se produce la corriente eléctrica.
El proceso químico no se presenta por tiempo indefinido, sino que después de algún tiempo deja de tener efecto (Se nota porque su voltaje va disminuyendo). Esta es la causa de que las baterías tengan una vida finita.
Baterías
 Las pilas secundarias o acumuladores son aquellas que pueden recargarse, es decir pueden reiniciar el proceso mediante el aporte de energía de una fuente exterior normal mente un generador, que hace que los compuestos químicos se transformen en los compuestos de partida, al hacer pasar corriente a través de ellos en sentido opuesto
Las pilas secundarias o acumuladores son aquellas que pueden recargarse, es decir pueden reiniciar el proceso mediante el aporte de energía de una fuente exterior normal mente un generador, que hace que los compuestos químicos se transformen en los compuestos de partida, al hacer pasar corriente a través de ellos en sentido opuestoUn acumulador es, por tanto, un aparato capaz de retener cierta cantidad de energía en su interior, suministrada externamente, para emplearla cuando la necesite.
Así, una batería está formada por varios acumuladores, y puede ser ácida o calina en función’de la naturaleza del electrolito. Por ejemplo, las baterías de los coches son ácidas, porque contienen un electrolito de ácido sulfúrico en el que se sumergen una placa de plomo metálico y otra de dióxido de plomo. Las reacciones en este caso son las siguientes:
H2SO4 ---> 2H+ + SQ42-
Cátodo:............... Pb + S042 ----> PbSO4 + 2e-
Ánodo: ........ PbO2 + S042- +4 H30+ + 2 e- ---> PbSO4 + 6 H20
Cuando se agota el plomo o el dióxido de plomo la batería está gastada y para recargarla se hace pasar una corriente eléctrica de la placa positiva a la negativa mediante un alternador o dinamo, de manera que el sulfato de plomo se vuelve a des componer en plomo en la placa negativa, y en la positiva en dióxido de plomo
En las baterías alcalinas el electrolito suele ser hidróxido potásico, y las placas son habitualmente, de níquel y de hierro.
Bibliografía
- Pilas y baterias que transforman la energía química en eléctrica. Disponible en: http://www.portalplanetasedna.com.ar/pilas.htm. Consulta: noviembre 29, 2011.
- Sitio de Electrónica Unicom. Cómo funcionan las pilas/baterias. Disponible en: http://www.unicrom.com/Tut_comofuncionanbaterias.asp. Consulta: noviembre 29, 2011.
No hay comentarios:
Publicar un comentario